2019년 12월 코로나 바이러스(SARS-COV-2)의 출현은 전 세계 인류의 정치, 사회, 문화, 과학, 예술 전 분야에 엄청난 충격을 안겨주었으며, 2022년 11월 현재 팬데믹 상황에서 엔데믹 상황으로 전환 중이다. 다만, 한국을 포함해 많은 국가들이 거리두기 및 실내외 마스크 착용의 기준을 완화한 상태이다. 그럼에도 불구하고, 세계 보건 기구(WHO: World Health Organization)에서는 지속적으로 코로나 바이러스 변이 가능성을 경고하고 있는 상황이다. 미국 전설의 야구 선수인 요기 베라(Yogi Berra)가 뉴욕 메츠 감독 시절에 했던 말인 “끝날 때까지 끝난 것이 아닌(It ain’t over till it’s over)” 상황이다.포스트 팬데믹 이후, 과학 분야, 그 중에서도 바이오 산업 분야에 가장 큰 변화를 가져온 것은 mRNA 기반의 코로나 백신의 개발이라고 할 수 있다. 화이자와 모더나가 선도한 mRNA 기반 코로나 백신의 상업화는 mRNA를 포함한 RNA 약물 개발 분야를 현대 제약/바이오 산업의 주류로 단번에 편입시켰다.
“코로나 바이러스가 확인된 지 5일 후에 바이러스 유전자 서열(viral genome)이 완전히 밝혀졌고, 모더나는 8일 후, 코로나 바이러스의 백신 후보(mRNA-1273)를 결정하였다. 이후 63일 만에, 미국 국립 보건원(NIH) 주도하의 임상 1상을 위한 첫 번째 백신 투여가 이루어졌다. 일반적으로 백신 개발 기간이 10~15년이 걸린다는 것을 감안하면, 모더나의 백신 개발 속도는 거의 광속에 가깝다고 할 수 있다.” [1]
모더나의 백신 개발 과정을 생각해 보면, 포스트 팬데믹 이후의 신약 개발은 약물 설계 및 개발에 따른 시간과 비용을 획기적으로 줄여야 하는 “시대적 요구”에 부응해야 될 상황으로 인식된다. 다행히도, 비약적 발전을 이루고 있는 인공 지능과 신약 개발의 만남은 포스트 팬데믹 이후 녹록지 않은 상황에 등판하여, 그 역할을 충실히 하고 있는 구원 투수로 여겨진다.
포스트 팬데믹에서의 신약 개발
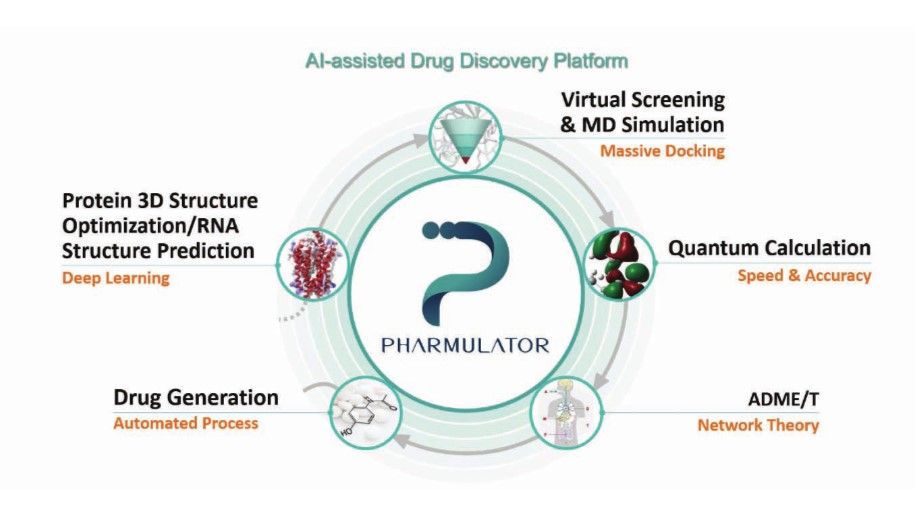
팜캐드는 효율적인 신약 개발을 위하여, AI 물리학(physics-based)을 접목시킨 기술들을 하나의 플랫폼으로 집약시킨 파뮬레이터(Pharmulator™)를 개발하였고, 현재 고도화 작업들을 진행시키고 있다. 파뮬레이터는 서로 다른 다섯 개의 모듈들로 구성되어 있다(그림 1). 첫 번째 모듈은 단백질 구조 예측 및 최적화이다. 타깃 단백질(target protein)의 3차원 결정 구조가 없는 경우, 파뮬레이터의 단백질 3차원 구조 예측 모듈을 통해, 타깃 단백질의 3차원 구조를 확보한다. 두 번째 모듈은 massive docking 기술을 이용한 초고속 VHTS(virtual High-Throughput Screening: 가상에서의 고성능 스크리닝) 모듈이다. 이를 통하여, ChEMBL이나 ZINC에 있는 다양한 저분자 화합물들을 빠르게 스크리닝하게 된다. Docking 결과가 좋은 화합물에 대해서, 분자 동역학(Molecular Dynamics; MD) 시뮬레이션 모듈을 이용하여 단백질의 생체 내 환경을 반영한 결합 친화도(binding affinity)를 보다 정확하게 계산한다. 세 번째 모듈은 양자 계산(quantum calculation) 모듈이다. 양자 계산 모듈을 통해, 스크리닝한 화합물들의 부분 전하(partial charge)와 같은 물리화학적 특성 값들을 계산함으로써, 타깃 단백질과 후보 약물의 결합을 전자 레벨에서 보다 정밀하게 이해한다. AI 기술을 활용하여, 약 10만 개 저분자 화합물들의 양자 계산을 통해 구축된 데이터를 학습시킨다. 이를 통하여, 새로운 후보 약물들의 다양한 물리/화학적 특성들을 빠르고 정확하게 예측한다. [2]
네 번째 모듈은 독성 예측 모듈이다. 독성 예측 모듈을 통해, 스크리닝한 저분자 화합물들의 다양한 잠재 독성(간독성, 심장 독성 등)들을 예측한다. 잠재 독성의 필터들을 통과한 저분자 화합물들에 대해, 약물 창출 모듈(drug generation)을 통해 새로운 신약 후보 물질을 도출하게 된다. 약물 창출 모듈은 수십만 개의 약물 데이터로 미리 학습(pre-training) AI를 활용하여, 타깃 단백질에 대해, 기존에 스크리닝한 화합물들보다 결합 친화도가 더 우수한 후보 물질들을 생성하게 된다. 이렇게 AI를 통해 생성된 후보 물질들은 파뮬레이터의 모듈을 통해 최적화(optimize)된다. 또한, 타깃 단백질 내에 화합물의 약물 잔류 시간(residence time)[3]을 반영하여, 성공 확률이 보다 높은 후보 물질들을 도출하게 된다.
포스트 팬데믹에서의 약물 전달 시스템
mRNA 기반의 코로나 백신의 상업화는 RNA와 약물 전달 시스템(DDS: Drug Delivery System) 기반의 백신 개발을 새로운 패러다임으로 전환시키는 과정에 있다. 실제로, 코로나 백신 이외의 항암 백신과 같은 분야에서 RNA/약물 전달 시스템 기반의 백신 연구들이 활발히 진행되고 있다.
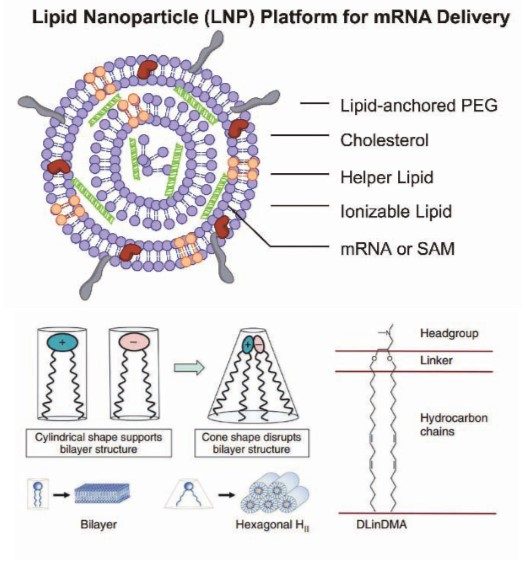
현재 약물 전달 시스템으로 가장 각광 받고 또한 활발한 연구가 진행되고 있는 물질이 지질 나노 입자(LNP: Lipid Nanoparticle)이다. 지질 나노 입자는 크게 Lipid-anchor 부분인 폴리에틸렌 글리콜(PEG: Polyethylene Glycol), 콜레스테롤, Helper lipid, 이온화 지질(ionizable lipid), 그리고 지질 나노 입자 내부에 탑재되는 RNA로 구성되어 있다(그림 2A). RNA/LNP 기반의 백신을 연구하는 제약 회사, 대학 및 연구소의 큰 관심사 중의 하나는 새로운 이온화 지질을 설계하고 개발하는 것이다. 이온화 지질은 head, linker, 탄화수소(hydrocarbon)로 구성되어 있다. Head 부분은 pH7 정도의 생리학적 조건에서는 중성으로 있다가 pH5 정도의 산성 환경에서는 양전하를 띄도록 설계되어 있다. 양전하는 phosphatidylserine과 같은 endosomal membrane의 음전하와 이온 결합을 통해, 결합이 생기기 전의 head 부분의 면적보다 훨씬 작아지게 된다(그림 2B). 결국, head 그룹 간의 이온 결합에 의해서 “cone”과 같은 형태를 이루고, inverted hexagonal phase(H)로 상전이(phase transition)가 일어난다. 이 상전이를 통하여, endosomal의 bilayer가 non-bilayer 형태로 바뀌면서, endosomal membrane의 균열(disruption)이 생기면서, 내부의 RNA가 지질 나노 입자로부터 빠져 나가는 endosomal release가 일어나게 된다.
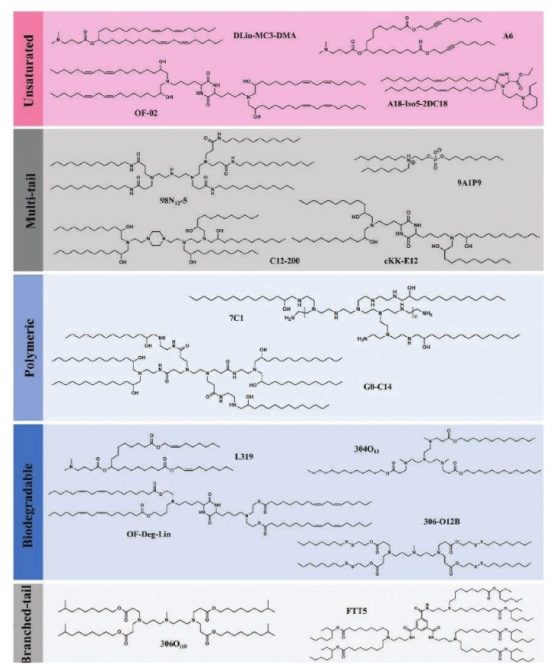
이온화 지질은 구조에 따라 크게 5종(unsaturated, multi-tail, polymeric, biodegradable, branched-tail)으로 분류된다(그림 3). DLin-MC3-DMA 구조를 보면, 불포화(unsaturated) 지질에 두 개의 cis 결합을 만들어서 이온화 지질이 쉽게 “cone” 형태가 되어 endosomal membrane 균열이 수월하게 일어나도록 설계하였다. 두 번째, multi-tail에서는 tail의 개수 증가에 따라 탄화수소의 단면적이 커지고, 이온화 지질의 형태를 “cone” 모양에 가까워지게 함으로써 endosomal membrane 균열이 수월하게 일어날 수 있도록 하였다. 이러한 장점에도 불구하고 tail 개수의 증가는 오히려 이온화 지질을 지나치게 안정화시킴으로써 생체 내에서 분해(degradation)가 잘 되지 않아 독성과 면역 반응의 문제를 야기시킨다. 이러한 문제는 생리적 pH에서는 안정하지만 조직이나 세포 내에서는 효소에 의해 쉽게 가수분해되는 에스터 결합(ester bond)을 추가하여 생분해가 용이한 이온화 지질(biodegradable ionizable lipid)을 설계함으로써 어느 정도 문제를 해결할 수 있다. 보다 안전하며 효능에서 뛰어난 이온화 지질 설계 및 개발은 현재 진행형이다.
팜캐드는 지난 7월 13일 롯데 시그니엘에서 세계 각국(캐나다, 네덜란드, 프랑스, 이탈리아)의 DDS 전문가들을 초청하여 “약물 전달 시스템과 백신”이라는 주제로 컨퍼런스를 개최하고, 현재 진행되고 있는 RNA 기반의 백신과 약물 전달 시스템의 동향에 대해 토론하는 자리를 마련하였다. 이 회의에 참석한 과학자들의 발표 제목과 내용을 간략히 요약하면, Peter Tieleman 교수는 “Opportunities for simulations in understanding lipid nanoparticle-based drug delivery systems”라는 주제로 지질 나노 입자와 생체 이중 막의 융합(fusion), Siewert-Jan Marrink 교수는 “Modeling realistic cell membranes” 주제로 핵산을 포함한 lipoplex와 생체 이중 막과의 융합 과정(fusion process), Luca Monticelli 박사는 “Interaction between biological membrane models” 주제로 지질 나노 입자의 자가 조직(self-assembly) 과정, Michele Schlich 교수는 “Lipid nanoparticles: application for miRNA delivery in glioblastoma” 주제로, miRNA dysregulation에 의해 생기는 뇌종양(glioblastoma)을 타겟으로 하는 지질 나노 입자 formulation 개발 상황, Paola Brocca 교수는 “Liposomes and polymer-lipid hybrid nanoparticles in interaction with the biological interfaces: experimental evidence at the nanoscale”라는 주제로, 점막과 같은 생체 인터페이스와 지질 나노 입자와의 상호 작용에 대해 각각 흥미로운 발표들을 하였다. 팜캐드의 Martina Pannuzo 박사와 필자는 “A computational approach to the rational design and optimization of lipid-based vaccine formulations for effective delivery of mRNA to target compartments”라는 주제로 multiscale 시뮬레이션[6]과 AI를 통한 이온화 지질의 설계에 대한 주제로 발표를 하였다. 팜캐드는 코로나 바이러스 출현 직후 코로나 백신에 대한 최적의 mRNA 염기 서열을 설계한 경험을 바탕으로, 포스트 팬데믹에서의 다양한 백신 개발을 위한 플랫폼 개발을 진행 중이다.

맺음말
지면이 허락한 범위 내에서 팜캐드의 포스트 팬데믹 이후의 신약 개발 플랫폼 기술과 지질 나노 입자를 중심으로 약물 전달 시스템에 대해 간략히 설명하였다. 포스트 팬데믹 이후 코로나 바이러스 자체에 대한 경각심은 전 세계적으로 조금은 누그러졌지만, 정치, 경제, 사회, 문화에 끼친 영향은 오히려 더 크게 나타나고 있다. 특히, 전 세계적으로 요동치는 경제 상황은 포스트 팬데믹 이후 신약 개발 분야에 큰 영향을 미칠 것으로 생각된다. 하지만, 인류 과학 발전의 역사를 돌이켜보았을 때, 팬데믹 이후 상황에서도 제약/바이오 산업의 발전은 멈추지 않고, 또 한 번의 “양자 점프(quantum leap)”가 있을 것으로 기대하며 글을 맺는다.
참고 문헌
[1] Lo Chris. (2021.03.31),“mRNA vaccines : the post-pandemic outlook after a breakthrough year “, Pharmaceutical Technology : https : // www. pharmaceutical-technology.com/analysis/mrna vaccines-pandemic-outlook.
[2] S. K. Mudedla, A. Braka and S. Wu.“Quantum based machine learning and Al models to generate force field parameters for drug-like small mol ecules”. Front Mol Biosci Oct 11, 1002535 (2022)
[3] M. J. Akhunzada, H. J. Yoon, I. Deb, A. Braka and S. Wu,“Bell Evans model and steered molecular dynamics in uncovering the dissocia tion kinetics of ligands targeting G protein coupled receptors”. Sci Rep 12, 15972 (2022).
[4] L. Miao, Y. Zhang and L. Huang“mRNA vac cine for cancer immunotherapy mRNA vaccine for cancer immunotherapy “Mol Cancer 20, 41 (2021)
[5] X. Han, H. Zhang, K. Butowska, K. L. Swingle, M. Alameh, D. Weisman, and M. J. Mitchell,”An ionizable lipid toolbox for RNA delivery “, Nat Commun 12, 7233 (2021).
[6] L. R. Kjolbye, G. P. Pereira, A. Bartocci, M. Pannuzzo, S. Albani, A. Marchetto, B. Jimènez Garcia, J. Martin, G. Rossetti, M. Cecchini, S. Wu, L. Monticelli and P. T. Souza,“Towards design of drugs and delivery systems with the Martini coarse-grained model.”QRB Discovery 1-51 (2022)

